temperature

- Dalam persamaan kekekalan energi pers. (2.51), energi kinetik mekanik, fluks daya, dan sumber dapat dihitung dari
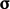 ,
, 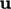 dan
dan 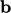 dari persamaan momentum (pers. (2.19)). Sumber panas dapat berkontribusi terhadap
dari persamaan momentum (pers. (2.19)). Sumber panas dapat berkontribusi terhadap 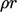 , misalnya dari radiasi termal, reaksi kimia, dll.
, misalnya dari radiasi termal, reaksi kimia, dll. - Demikian itu meninggalkan istilah fluks panas
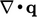 yang mewakili konduksi panas. Ini umumnya dimodelkan oleh hukum Fourier yang menyatakan bahwa q proposional dengan gradien negatif suhu T, yaitu :
yang mewakili konduksi panas. Ini umumnya dimodelkan oleh hukum Fourier yang menyatakan bahwa q proposional dengan gradien negatif suhu T, yaitu :
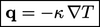 | (2.54) |
- di mana konstanta proporsionalitasnya adalah konduktivitas termal k
Temperature scale
- Persamaan fluks panas Pers. (2.54) memerlukan definisi dan kemampuan untuk mengukur suhu. Pengukuran memerlukan skala. Skala empiris menghubungkan suhu dengan properti fisik yang diukur dari zat kerja, misalnya, tegangan EMF di persimpangan dua paduan logam. Skala empiris memiliki kelemahan: bergantung pada zat kerja; dan tidak secara aktual mendefinisikan suhu itu sendiri.
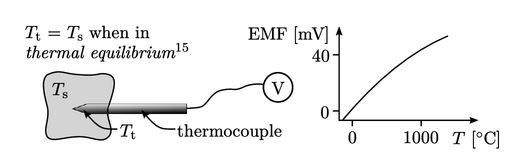
- Sebaiknya, skala termodinamika mendefinisikan suhu sebagai pengukuran dari rata-rata energi kinetik dari gerakan acak konstituen partikel materi. Skala ini memberikan pengukuran mutlak dari suhu yang independen dari pilihan zat kerja dan mencakup titik nol. Suhu pada skala ini harus diukur dalam satuan dengan titik nol, seperti satuan SI Kelvin, K.
- Sustitusi model kita pers. (2.54) dalam pers. (2.51) menghasilkan istilah
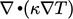 . Adalah logis bahwa ini merupakan istilah Laplacian karena mewakili difusi yang terkait dengan gerakan acak partikel submikroskopik, seperti yang telah kita tetapkan dalam bagian 2.14.
. Adalah logis bahwa ini merupakan istilah Laplacian karena mewakili difusi yang terkait dengan gerakan acak partikel submikroskopik, seperti yang telah kita tetapkan dalam bagian 2.14.
Ideal Gas
- Perilaku banyak gas dalam kondisi kerja yang tipikal dapat dijelaskan oleh persamaan keadaan gas ideal.
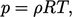 | (2.55) |
- dimana konstanta gas spesifiknya adalah
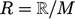 . Itu dihitung dari Konstanta Gas Universal
. Itu dihitung dari Konstanta Gas Universal 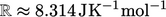 dalam satuan SI, dan massa molar
dalam satuan SI, dan massa molar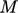 gas, dengan satuan
gas, dengan satuan 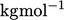 .
. - Persamaan gas ideal berasal dari termodinamika klasik sebagai kombinasi hukum empiris17. Kemudian, ia diturunkan dari prinsip pertama termodinamika statistik dan teori kinetik, dengan suhu mewakili energi kinetik rata-rata.
- Penurunan tersebut mengasumsikan bahwa molekul tidak memiliki volume, mengalami tumbukan elastik murni, dan tidak ada gaya antarmolekul.
- Skala suhu yang ditentukan oleh persamaan keadaan gas ideal sama persis dengan skala suhu termodinamika.
