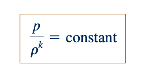Hubungan Gas Ideal
Hubungan gas ideal. Sebelum kita dapat melanjutkan untuk mengembangkan persamaan aliran dapat dipadatkan, kita perlu menjadi lebih akrab dengan fluida yang akan kita kerjakan, yaitu gas ideal. Secara khusus, kita harus belajar bagaimana mengevaluasi perubahan sifat gas ideal. Persamaan keadaan untuk gas ideal adalah
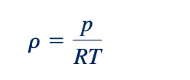
Kita sudah membahas tekanan fluida, p, densitas, ρ, dan suhu, T, dalam bab-bab sebelumnya. Konstanta gas, R, mewakili sebuah konstanta untuk setiap gas ideal yang berbeda atau campuran dari gas ideal, di mana
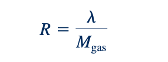
Dengan notasi ini, 𝜆 adalah konstanta gas universal dan M gas adalah berat molekul gas ideal atau campuran gas ideal. Terdaftar dalam Tabel 1.7 dan 1.8 adalah nilai-nilai konstanta gas dari beberapa gas yang umum digunakan. Dengan mengetahui tekanan dan suhu suatu gas, kita dapat memperkirakan densitasnya. Persamaan keadaan gas non-ideal berada di luar lingkup teks ini, dan mereka yang tertarik pada topik ini diarahkan ke teks tentang termodinamika rekayasa, misalnya, Ref. 2. Perhatikan bahwa tren-tren aliran gas ideal umumnya merupakan indikator yang baik tentang perilaku aliran gas non-ideal.
Untuk gas ideal, energi internal, u, adalah bagian dari energi tersimpan dari gas seperti yang dijelaskan di Bagian 5.3 dan dianggap sebagai fungsi suhu saja (Ref. 2). Dengan demikian, panas spesifik gas ideal pada volume konstan, cv , dapat dinyatakan sebagai
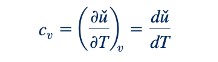
di mana subskrip v pada turunan parsial merujuk pada diferensiasi pada volume spesifik konstan, v= 1/p . Dari Persamaan 11.3, kita menyimpulkan bahwa untuk gas ideal tertentu, cv adalah fungsi dari suhu saja. Persamaan 11.3 dapat diubah susunannya untuk menghasilkan
Dengan demikian
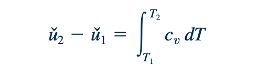
Persamaan 11.4 berguna karena memungkinkan kita untuk mengevaluasi perubahan energi internal, u2-u1 , yang terkait dengan aliran gas ideal dari bagian (1) ke bagian (2) dalam suatu aliran. Untuk kesederhanaan, kita dapat mengasumsikan bahwa cv konstan untuk gas ideal tertentu dan mendapatkan dari Persamaan 11.4
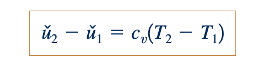
Sebenarnya, cv untuk gas tertentu bervariasi dengan suhu (lihat Ref. 2). Namun, untuk perubahan suhu yang moderat, asumsi konstan cv adalah wajar.
Properti fluida entalpi, ℎ∗ , didefinisikan sebagai

Ini menggabungkan energi internal, u∗, dan energi tekanan, p/ρ, dan berguna saat menangani persamaan energi (Persamaan 5.692). Untuk gas ideal, kami telah menyatakan bahwa
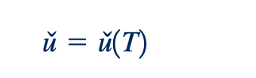
Dari persamaan keadaan (Persamaan 11.12)
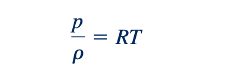
Oleh karena itu, dapat disimpulkan bahwa
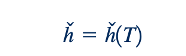
Karena untuk gas ideal, entalpi merupakan fungsi dari suhu saja, panas spesifik gas ideal pada tekanan konstan, cp , dapat dinyatakan sebagai
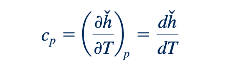
di mana subskrip p pada turunan parsial merujuk pada diferensiasi pada tekanan konstan, dan cp merupakan fungsi dari suhu saja. Penyusunan kembali Persamaan 11.7 menghasilkan
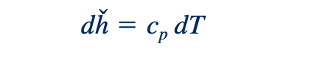
Dan
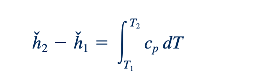
Persamaan 11.8 berguna karena memungkinkan kita untuk mengevaluasi perubahan entalpi, ℎ∗ , yang terkait dengan aliran gas ideal dari bagian (1) ke bagian (2) dalam suatu aliran. Untuk kesederhanaan, kita dapat mengasumsikan bahwa cp konstan untuk gas ideal tertentu dan mendapatkan dari Persamaan 11.8
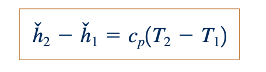
Seperti halnya untuk cv , nilai cp untuk gas tertentu bervariasi dengan suhu. Namun demikian, untuk perubahan suhu yang moderat, asumsi cp konstan adalah wajar.
Dari Persamaan 11.5 dan 11.9, kita melihat bahwa perubahan energi internal dan entalpi berkaitan dengan perubahan suhu oleh nilai cv dan cp. Sekarang kita beralih untuk mengembangkan hubungan yang berguna untuk menentukan cv dan cp. Dengan menggabungkan Persamaan 11.6 dan 11.1 kita mendapatkan
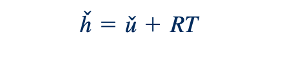
Diferensiasi Persamaan 11.10 menghasilkan

Atau
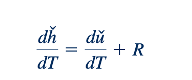
Dari Persamaan 11.3, 11.7, dan 11.11, kita dapat menyimpulkan bahwa
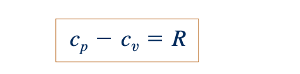
Persamaan 11.12 menunjukkan bahwa perbedaan antara cp dan cv konstan untuk setiap gas ideal terlepas dari suhu. Juga cp > cv . Jika rasio panas spesifik, k, didefinisikan seperti
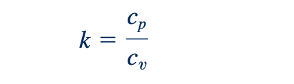
kemudian dengan menggabungkan Persamaan 11.12 dan 11.13 menghasilkan

Dan
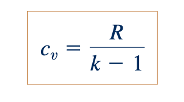
Sebenarnya, cp , cv , dan k semuanya agak bergantung pada suhu untuk setiap gas ideal. Kita akan mengasumsikan nilai konstan untuk variabel-variabel ini dalam buku ini. Nilai-nilai k dan R untuk beberapa gas yang umum digunakan pada suhu nominal tercantum dalam Tabel 1.7 dan 1.8. Nilai-nilai yang tercantum ini dapat digunakan dengan Persamaan 11.13 dan 11.14 untuk menentukan nilai-nilai cp dan cv . Contoh 11.1 menggambarkan bagaimana perubahan energi internal dan entalpi dapat dihitung untuk gas ideal yang mengalir dengan cp dan cv konstan.


Untuk aliran yang dapat dipadatkan, perubahan dalam sifat termodinamika entropi, s, penting. Untuk setiap substansi murni termasuk gas ideal, "persamaan T ds pertama" adalah

di mana T adalah suhu absolut, s adalah entropi, u∗ adalah energi internal, p adalah tekanan absolut, dan ρ adalah densitas. Diferensiasi Persamaan 11.6 menghasilkan
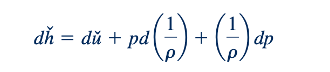
Dengan menggabungkan Persamaan 11.16 dan 11.17, kita mendapatkan
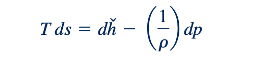
Persamaan 11.18 sering disebut sebagai "persamaan T ds kedua." Untuk gas ideal, Persamaan 11.1, 11.3, dan 11.16 dapat digabungkan untuk menghasilkan
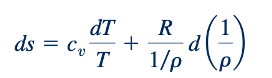
dan Persamaan 11.1, 11.7, dan 11.18 dapat digabungkan untuk menghasilkan

Jika cp dan cv diasumsikan konstan untuk suatu gas tertentu, Persamaan 11.19 dan 11.20 dapat diintegrasikan untuk mendapatkan
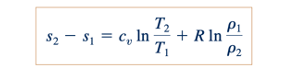
Dan
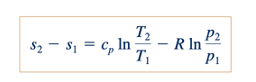
Persamaan 11.21 dan 11.22 memungkinkan kita untuk menghitung perubahan entropi dari gas ideal yang mengalir dari satu bagian ke bagian lain dengan nilai panas spesifik konstan cp dan cv.

Jika perubahan energi internal, entalpi, dan entropi untuk aliran gas ideal dengan panas spesifik variabel diinginkan, Persamaan 11.4, 11.8, dan 11.19 atau 11.20 harus digunakan seperti yang dijelaskan dalam Ref. 2. Tabel-tabel rinci yang tersedia, misalnya Ref. 32, untuk perhitungan panas spesifik variabel.
Hukum kedua termodinamika mensyaratkan bahwa aliran adiabatik dan tanpa gesekan dari suatu fluida menghasilkan ds= 0 atau s2 −s1 = 0. Aliran dengan entropi konstan disebut aliran isentropik. Untuk aliran isentropik dari gas ideal dengan cp dan cv konstan, kita dapatkan dari Persamaan 11.21 dan 11.22
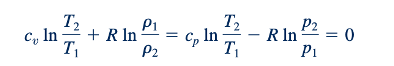
Dengan menggabungkan Persamaan 11.23 dengan Persamaan 11.14 dan 11.15, kita mendapatkan

yang merupakan hubungan yang berguna antara suhu, densitas, dan tekanan untuk aliran isentropik dari gas ideal. Dari Persamaan 11.24, kita dapat menyimpulkan bahwa